علت تأیید و تکذیب کشف داروی مؤثر درمان کرونا در آبادان
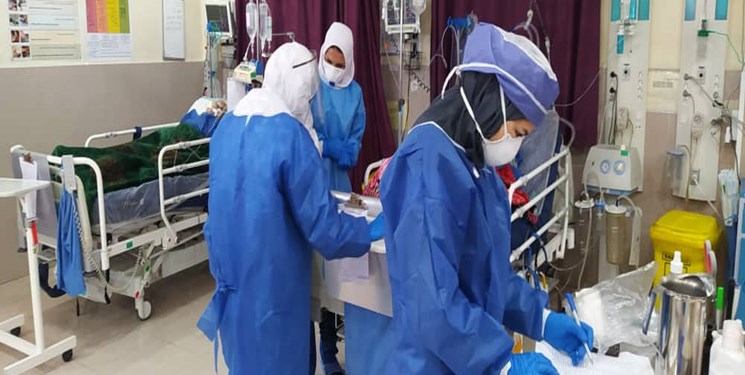
دانشکده علوم پزشکی و خدمات بهداشتی درمانی شهرستان آبادان در بررسی تأثیر یک داروی ضد ویروسی روی بیماران بدحال مبتلا به کووید-۱۹ بستری در بخش مراقبتهای ویژه بیمارستان آیتالله طالقانی آبادان توسط گروه عفونی این دانشکده، خبر از موفقیت در درمان این بیماران و کاهش طول بستری در بیمارستان داد.
پیدایش نوع جدیدی از داروی مؤثر و واکنشهای متناقض
واکنشهای مختلف اما متناقضی در قبال اعلام خبر کشف دارویی مؤثر در درمان ویروس کرونا توسط دانشکده علوم پزشکی آبادان ایجاد شد که در نخستین اظهار نظر، دانشگاه علوم پزشکی جندی شاپور اهواز ساخت این دارو را توسط دانشکده علوم پزشکی آبادان تکذیب کرد که این موضوع با واکنش نهاد متولی سلامت در آبادان همراه بود.
رئیس سازمان غذا و داروی کشور اما، در پاسخ به سوالی درباره برخی ادعاها مبنی بر کشف یک ترکیب دارویی ضد کرونا در آبادان، گفت: در یک ماه گذشته ادعاهای زیادی در حوزه دارو و درمان کرونا مطرح شده؛ به این منظور یک کمیته علمی در سازمان غذا و دارو شکل گرفته که همه موارد ادعایی و مستندات ارائه شده را بررسی میکند و اگر حداقلهای علمی را داشته باشند، این ادعاها به کمیته علمی وزارت بهداشت ارجاع میشود. باید بگویم ادعاهای اینچنینی در یک ماه اخیر کم نبوده است؛ اما بخش اعظمی نتوانستهاند مستندات درستی ارائه کنند.
دانشکده علوم پزشکی و خدمات بهداشتی درمانی شهرستان آبادان اما، ساعتی بعد جوابیهای در پاسخ به این واکنش صادر کرده که در آن، عنوان شده بود این تجربه موفق حاصل یک کارآزمایی بالینی مبتنی بر روشهای کاملاً علمی و با رعایت اصول اخلاقی زیر نظر وزارت بهداشت، درمان و آموزش پزشکی و اخذ مجوزهای لازم بوده و نتایج به دست آمده کاملاً علمی و موثق است.
دلیل اصلی انتشار تکذیبیه
اما چرا دانشگاه علوم پزشکی جندی شاپور اهواز در این خصوص تکذیبیه منتشر کرده بود؟
یک کارشناس پژوهشی در خصوص اعلام کشف داروی مؤثر در درمان مبتلایان به ویروس کرونا و دلایل تکذیب آن از سوی دانشگاه جندی شاپور اهواز، به خبرنگار فارس گفت: این فرآیند تحقیقاتی یک مشکل اساسی دارد و این مشکل اینجاست که هر کارآزمایی بالینی که قرار است بر روی بیمار آزمایش شود، باید حتما کد IRCT داشته باشد.

این کارشناس پژوهشی تصریح کرد: باید در تعریف طرح، عنوان میشد که قرار بر آزمایش این دارو روی چه تعداد مشخصی از بیماران است تا پس از آن سامانه IRCT مجوز چنین کاری را صورت دهد. این مرکز در پایتخت قرار دارد و مجوز استفاده از این دارو، باید از سوی این نهاد صادر شود.وی با بیان اینکه این کد به معنای آن است که داروی مورد اشاره باید در سامانه IRCT ایران پیش از اینکه این پروسه به بیماریابی برسد ثبت شود، افزود: این پروسه اصلاً نیازی به حضور در بالین بیمار ندارد و از فرآیندی کاملاً سیستماتیک برخوردار و یک قانون کشوری و جهانی است.
وی یادآور شد: اتفاقی که در دانشکده علوم پزشکی آبادان افتاده است، گرچه مؤثر اما کد IRCT ندارد و پس از اینکه گفته شد روی ۶۰ بیمار آزمون شده، گویا فرآیند ثبت سیستماتیک آن آغاز و نسبت به ارسال پروپوزالها اقدام شده و هنوز مجوزی برای تجویز آن داده نشده است.
این کارشناس پژوهشی در استان خوزستان با اشاره به اینکه در ارتباط با تهیه داروی بیماری کرونا، تاکنون چند طرح در این سامانه به ثبت رسیده که توسط شهرهایی همچون اصفهان، قزوین، تهران، ساری و .. صورت گرفته است، خاطرنشان کرد: در حال حاضر دانشکده علوم پزشکی آبادان مراحل قانونی استفاده از این داروی ترکیبی را صورت نداده و دانشگاه علوم پزشکی اهواز به همین خاطر با این موضوع مخالفت و مقابله کرده است.
به گزارش خبرگزاری فارس، پیش از این و در ابتدای راهاندازی platform بینالمللی ثبت کارآزماییهای بالینی در ایران، معاونت تحقیقات وزارت بهداشت وقت در سال ۱۳۸۸ در ابلاغی به دانشگاههای علوم پزشکی اعلام کرد ثبت کارآزمایی قبل از عقد قرارداد به منظور استانداردسازی وضعیت ثبت کارآزمایی بالینی مصوب دانشگاههای علوم پزشکی صورت میگیرد.
بر اساس این ابلاغ با توجه به موافقت وزیر وقت بهداشت، درمان و آموزش پزشکی مبنی بر ثبت اجباری کارآزماییهای بالینی به منظور انتشار مقالات این طرح ها در مجلات پژوهشی، دانشگاه علوم پزشکی موظف شدند پیش از عقد قرارداد پژوهشی، کارآزمایی بالینی آن طرح را در مرکز ثبت کارآزمایی بالینی های ایران IRCT ثبت کنند.
لزوم رعایت بندهای سامانه IRCT برای ثبت یک طرح
بنا بر این گزارش، فرآیند ثبت کارآزمایی در سامانه IRCT دارد که شامل چند بند است که مروری بر آنها خواهیم داشت؛
* برای تایید نهایی ثبت کارآزمایی بالینی در مرکز داشتن مصوبه کمیته اخلاق معتبر ضروری است.
* کارآزمایی های بالینی که در ایران اجرا میشوند بایستی به دو زبان فارسی و انگلیسی در مرکز ثبت کارآزمایی بالینی ثبت شوند. بخش انگلیسی و فارسی باید قرینه یکدیگر باشند.

* پس از تأیید ثبت یک کارآزمایی بالینی در مرکز ثبت کارآزمایی بالینی ایران امکان حذف آن را نخواهید داشت.* اطلاعات وارد شده توسط شما پس از تأیید نهایی در معرض عموم قرار خواهد گرفت.
* فرآیند ثبت کارآزمایی بالینی بایستی پیش از گرفتن اولین بیمار به پایان رسیده باشد.
* در مرکز مورد اشاره فقط مطالعات مداخلهای کارآزمایی بالینی برروی انسان ثبت میشوند و نباید اطلاعات مطالعات حیوانی و غیر کارآزمایی را در این سایت وارد شود.
* یک رکورد جدید برای هر مطالعه کارآزمایی درست شود، اگر مطالعهای را که میخواهید ثبت کنید بخشی از یک مطالعه بزرگتر است، باید از درست کردن رکوردهای متعدد برای یک مطالعه واحد اکیداً پرهیز شود.
* یک مطالعه کارآزمایی بالینی باید یکجا ثبت شود حتی اگر در قالب پایان نامه چندین دانشجو تعریف شود.
* اگر مطالعهای که ثبت میشود بخشی از پایاننامه دانشجویی است فقط مطالعه کارآزمایی بالینی باید ثبت شود و از وارد کردن اطلاعات کل پایاننامه پرهیز شود.
* همچنین ارائه پایان کار به طرح های کارآزمایی بالینی در حال اجرا نیز منوط به ارائه شماره ثبت در مرکز ثبت کارآزمایی های بالینی ایران است.
ثبت ۱۱ طرح کارآزمایی بالینی پیش از دانشکده علم پزشکی آبادان
خبرنگار خبرگزاری فارس در استان خوزستان در بررسی فرآیند ثبت کارآزمایی، به سامانه IRCT مراجعه و نحوه ثبت کارآزماییهای بالینی را بررسی کرد که مشخص شد این سامانه از سال ۱۳۸۳ با اعلام عمومی توسط کمیته بینالمللی ناشران مجلات علوم پزشکی با چاپ سرمقالهای در ۱۱ مجله برتر بینالمللی رسمیت پیدا کرد.

در سال ۱۳۸۴ سازمان بهداشت جهانی platform بینالمللی ثبت کارآزماییهای بالینی را تأسیس و ضمن تهیه و تدوین استانداردهای مربوطه، شبکه مراکز ثبت مورد تأیید خود را بنیان نهاد.
مرکز ثبت کارآزمایی بالینی ایران در سال ۱۳۸۷ تأسیس و همان سال به عضویت شبکه مراکز ثبت مورد تأیید سازمان بهداشت جهانی درآمد.
بر اساس دستورالعملهای این سامانه ثبت کارآزماییهای بالینی باید آیندهنگر باشد یعنی پیش از شروع بیمارگیری انجام گیرد، ثبت پس از شروع بیمارگیری گذشتهنگر محسوب شده و مورد قبول بسیاری از مجلات معتبر علوم پزشکی در جهان نیست.
بر اساس این گزارش، تا به اکنون ۱۱ عنوان پژوهش در مورد کووید-۱۹ در سامانه ثبت مطالعات کار آزمایی بالینی ایران قرار گرفته است که به شرح ذیل است؛
۱- بررسی تاثیر تجویز داروی NOSCOVID بر تظاهرات ریوی و سایر علایم بالینی بیماران مبتلا به COVID-19 دانشگاه علوم پزشکی قزوین؛ این مطالعه کارآزمایی بالینی بر روی تعداد ۱۲۵ بیمار (n=125) مبتلا به بیماری کووید – در دو گروه بیماران سرپایی و گروه بیماران بستری انجام گرفت. هر دو گروه بیماران سرپایی و بیماران بستری به دو گروه کنترل و دریافت کننده دارو (نوسکاپین ۲۵ میلی گرم) تقسیمبندی میشوند.
۲- بررسی اثربخشی و ایمنی تجویز داروی توسیلیزومب (Tocilizumab) در بیماران مبتلا به کورونا ویروس COVID-19 بیمارستان مسیح دانشوری، بیماران رژیم دارویی هیدروکسی کلروکین ۴۰۰ میلی گرم به صورت خوراکی دوبار در روز و اسلتامیویر ۷۵ میلی گرم به صورت خوراکی دوبار در روز و لوپیناویر-ریتوناویر ۲۰۰/۵۰ میلی گرم به صورت خوراکی ۲ قرص BID را برای ۵ روز دریافت می کنند. همچنین بیماران توسیلیزومب تزریقی را با دوز ۴۰۰ میلی گرم به صورت انفوزیون وریدی دریافت می کنند.
۳- بررسی اثر پلاسمای بهبود یافته بر پیامد بیماران مبتلا به COVID-19 بستری در ICU: یک مطالعه کارآزمایی بالینی بخش ICU بیمارستان امام خمینی شهر ساری؛ مداخله مورد ارزیابی انتقال پلاسمای بهبود یافته به بیماران مبتلا به COVID-19 بستری در ICU است.
۴- کارآزمایی بالینی کنترل شده تصادفی آیندهنگر برای مقایسه اثر درمانی داروی سووداک (Sofosbuvir/Daclatasvir) با درمان استاندارد مراقبتی در بیماران مبتلا به ویروس کورونا (کووید-۱۹) متوسط تا شدید بیمارستان شریعتی توسط محققان پژوهشکده بیماریهای گوارش و کبد (دانشگاه علوم پزشکی تهران) ۷۰ بیمار مبتلا به کووید-۱۹ متوسط تا شدید با نسبت ۱:۱ ۱٫ درمان استاندارد مراقبتی ۲. قرص سووداک (Sofosbuvir 400mg/Daclatasvir 60mg) + درمان استاندارد.
۵- بررسی اثرات درمانی و عوارض جانبی تجویز اینترفرون بتا ١-آ به صورت زیرجلدی در بیماران مبتلا به کرونا ویروس جدید (COVID-19) بیمارستان دکتر مسیح دانشوری؛ بیماران رژیم دارویی هیدروکسی کلروکین ۴۰۰ میلیگرم به صورت خوراکی دو بار در روز و اسلتامیویر ۷۵ میلیگرم به صورت خوراکی دوبار در روز و لوپیناویر-ریتوناویر ۲۰۰/۵۰ میلیگرم به صورت خوراکی ۲ قرص BID را برای ۵ روز دریافت می کنند. همچنین بیماران اینترفرون بتا ١-آ ۴۴ میلیگرم یک روز درمیان به صورت زیرجلدی تا ۱۰ روز دریافت میکنند.
۶- بررسی اثربخشی و ایمنی ترکیب هیدروکسی کلروکین + لوپیناویر یا آتازاناویر/ ریتوناویر در بیماران با COVID-19 مجتمع بیمارستان امام خمینی تهران؛ بیماران قرص هیدروکسی کلروکین ۴۰۰ میلیگرم دوبار در روز در روز اول سپس ۲۰۰ میلی گرم دو بار در روز + قرص لوپیناویر/ ریتوناویر ۲۰۰/۵۰ میلی گرم دو قرص دوبار در روز یا قرص آتازاناویر/ ریتوناویر ۳۰۰/۱۰۰ میلیگرم یک بار در روز برای حداقل ۵ روز دریافت میکنند.

۷- بررسی اثربخشی و ایمنی اینترفرون بتا-۱ بی (IFN β-۱b) در درمان COVID-19 بیمارستان امام خمینی تهران؛ بیماران گروه مداخله علاوه به ترکیب پیشنهادی کمیته کشوری، اینترفرون بتا یک بی (شرکت زیست دارو دانش) با دوز ۲۵۰ میکروگرم یکروز درمیان بصورت تزریق زیر جلدی برای مدت ۱۴ روز دریافت می کنند. گروه کنترل تنها رژیم پیشنهادی کمیته کشوری را دریافت می کنند. بیماران بهصورت یکروز در میان از نظر پاسخ به درمان و عوارض جانبی تا انتهای درمان پیگیری میشوند.
۸- بررسی اثربخشی و ایمنی اینترفرون بتا-۱ ای (IFN Β-۱a) در درمان عفونت COVID-19 بیمارستان امام خمینی تهران؛ بیماران وارد شده به مطالعه بر اساس روش Permuted Block Randomization در گروه مداخله یا گروه کنترل قرار می گیرند. بیماران گروه مداخله علاوه به ترکیب پیشنهادی کمیته کشوری، اینترفرون بتا یک ای با دوز ۴۴ میکروگرم یکروز در میان بهصورت تزریق زیر جلدی برای مدت ۱۴ روز دریافت می کنند. گروه کنترل تنها رژیم پیشنهادی کمیته کشوری را دریافت می کنند. بیماران بهصورت یکروز درمیان از نظر پاسخ به درمان و عوارض جانبی تا انتهای درمان پیگیری میشوند.
۹- بررسی اثربخشی و ایمنی سوفوسبویر/ لدیپاسویر در درمان COVID-19 مجتمع بیمارستانی امام خمینی، تهران؛ بیماران وارد شده به مطالعه بر اساس روش Permuted Block Randomization در گروه مداخله یا گروه کنترل قرار میگیرند. بیماران گروه مداخله علاوه به ترکیب پیشنهادی کمیته کشوری، یک قرص سوفوسبوویر/ لدیپاسویر ۴۰۰/۹۰ میلیگرم روزانه برای مدت ۱۰ روز دریافت میکنند. گروه کنترل تنها رژیم پیشنهادی کمیته کشوری را دریافت می کنند. بیماران بهصورت روزانه از نظر پاسخ به درمان و عوارض جانبی تا انتهای درمان پیگیری میشوند.
۱۰- فرمولاسیون دو فرآورده خوراکی گیاهی (شربت و محلول) و مطالعه اثرات آنها در بیماران مبتلا به COVID-19 به روش کارآزمایی بالینی بیمارستان های تابعه ی دانشگاه علوم پزشکی ایران
بیماران گروه مداخله علاوه بر درمان استاندارد پیشنهادی کمیته کشوری، محلول کرواستاپ را به میزان ۱۰ سی سی سه بار در روز و شربت کروگارد را به میزان ۳۰ سی سی سه بار در روز بهصورت خوراکی برای مدت ۱۰ روز دریافت می کنند؛ گروه کنترل تنها رژیم استاندارد را دریافت میکنند.
۱۱- اثر داروی نانو کمپوزیت ژنتیکی با سطح ایمنی سلولی برای مقابله با ویروس کرونا (COVID-19) بیمارستان شهید صدوقی اصفهان؛ گروهها عبارتند از بیماران آلوده به ویروس کرونا که وضعیت آلودگی ویروسی آنها به سه سطح اولیه و ثانویه و پیشرفته که همه بیماران از داروهای تجویزی توسط متخصصان به همراه داروی جدید استفاده میکنند بهجز گروه کنترل که فقط از داروهای تجویزی استفاده میکنند.
ضرورت پژوهش مانع ثبت طرح کارآزمایی
به گزارش خبرگزاری فارس، مشخص شد که دانشکده علوم پزشکی آبادان بر اساس ضرورتهای موجود اقدام به پژوهش و تهیه ترکیبی از داروها کرده است که در زمان فعلی، شاید مجالی برای ثبت این پروتکل احتمالاً موفق وجود نداشته و تنها مشکل این طرح که نتایج مثبت آن، محرز قلمداد شده، عدم دریافت کد از سامانه IRCT است.

سرپرست دانشگاه علوم پزشکی اهواز در توجیه اظهار نظرهای صورت گرفته توسط این دانشگاه، خاطرنشان کرد: یک رسانه درخصوص معرفی داروی جدید توسط دانشکده پزشکی آبادان به اشتباه نوشته بود که داروی جدیدی ساخته شده است که ساخت این داروی جدید را رد میکنیم اما ایجاد داروی جایگزین را رد نکردیم.
پس از اظهارات انجام شده توسط مقامات مختلف در حوزه سلامت؛ دانشگاه علوم پزشکی اهواز سرانجام پذیرفت که این دارو میتواند امیدبخش باشد و در گفتوگویی توسط یکی از مدیران این حوزه، عنوان شد: دانشکده پزشکی آبادان یک دارو را جایگزین داروی پروتکل وزارت بهداشت کرده و در تحقیقات نخست موفقیتآمیز بوده است و امیدواریم با آغاز تحقیقات گسترده به نتیجه مطلوب برسیم.
برچسبها:

